21世紀經濟報道記者季媛媛 上海報道
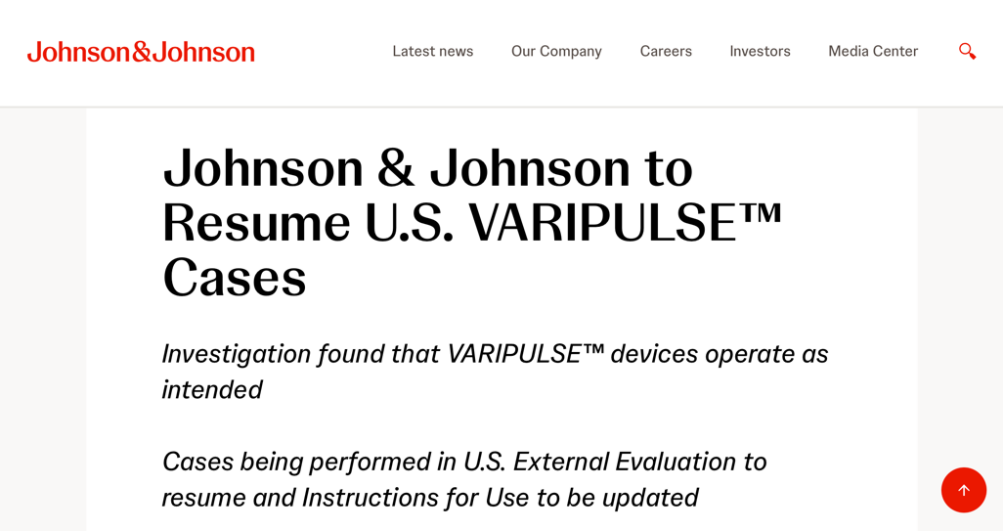
美國當地時間2月28日,美國食品藥品監督管理局(FDA)在其官方網站發布了對于強生PFA導管VARIPULSE進行召回的公示。值得注意的是,此次行動被歸類為糾正性召回,而非產品撤回。
FDA要求對該產品的說明書進行更新,以對醫生和手術增加更詳細的建議和指導。

此前,出于謹慎考慮,強生曾宣布臨時暫停VARIPULSE在美國進行外部臨床評估,并對潛在的器械、手術和患者等相關因素進行了全面調查。經過調查后,強生公司已在其官網發布聲明,證實VARIPULSE可按預期發揮治療作用,并且全球范圍內可用的VARIPULSE配置的性能之間均無差異。
VARIPULSE導管于2024年11月順利獲得FDA批準。除了美國之外,該產品目前已在歐洲、日本、加拿大和韓國獲批使用。在歐洲inspIRE和美國admIRE上市前臨床研究中,主要不良事件發生率分別為0%和2.9%,并未發生嚴重事件。
值得一提的是,1月27日,國家藥品監督管理局(NMPA)也發布公示了:VARIPULSE一次性使用磁定位心臟脈沖電場消融導管和TRUPULSE Generator心臟脈沖電場消融系統這兩款創新產品在中國正式獲批上市,標志著這款創新產品即將正式進入中國市場。

















